In una svolta promossa da AlphaFold, gli scienziati hanno mappato la struttura della grande proteina che dà la forma al “colesterolo cattivo” – una scoperta che potrebbe aiutare a trasformare il modo in cui ricercatori e medici trattano la principale causa di morte nel mondo
La corsa per scoprire una proteina chiave dietro le malattie cardiache è stata a lungo sia un importante obiettivo di salute pubblica che un ostinato problema scientifico.
Anche per i professori assistenti Zachary Berndsen e Keith Cassidy dell’Università del Missouri (Mizzou) si è trattato di una questione personale. Entrambi hanno una storia familiare di malattie cardiache: un promemoria di ciò che è in gioco nel loro lavoro per comprendere meglio e, in definitiva, aiutare a curare questa condizione mortale.
“Per 50 anni, le persone hanno voluto vedere che aspetto avesse questa proteina”, afferma Berndsen.
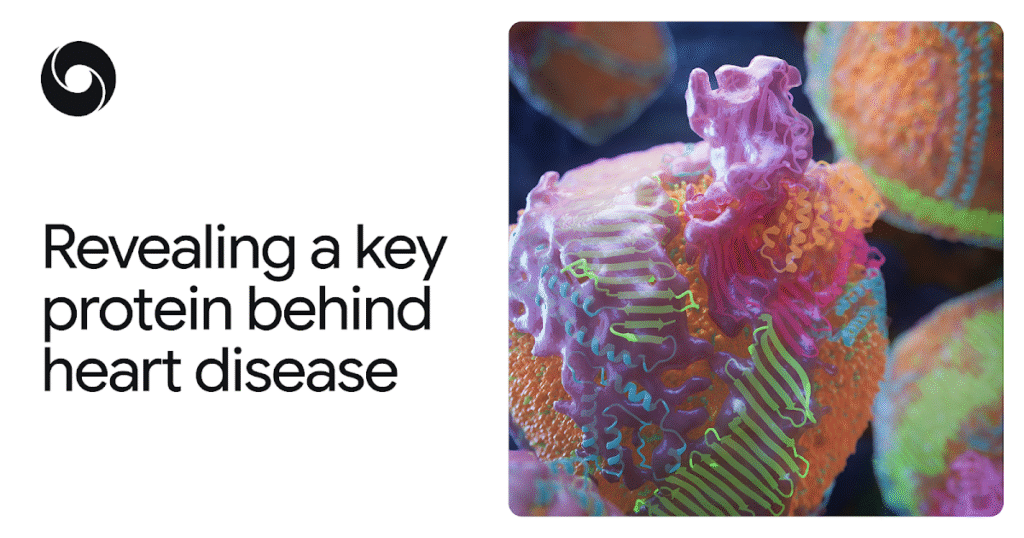
Quella proteina, apoB100, ha sfidato la mappatura non solo perché è enorme (per una proteina), ma anche perché si collega ai grassi e ad altre molecole in modi complicati. ApoB100 costituisce l’impalcatura molecolare del “colesterolo cattivo”, noto agli scienziati come lipoproteine a bassa densità (LDL).
L’LDL è il principale trasportatore di grasso attraverso il flusso sanguigno e un fattore di rischio chiave per la malattia cardiovascolare aterosclerotica (ASCVD), la principale causa di morte nel mondo. La scoperta della struttura della sua proteina chiave ha promesso di far luce su come il colesterolo cattivo diventa dannoso all’interno del corpo, offrendo agli scienziati maggiori possibilità di sviluppare modi per prevenire e curare l’ASCVD. AlphaFold sta svolgendo un ruolo centrale in questo sforzo.
A Mizzou, il biochimico Berndsen utilizzò per primo la microscopia crioelettronica (crio-EM) per catturare immagini di particelle LDL. Le immagini non erano sufficientemente nitide per mappare la struttura di apoB100 con precisione atomica, quindi il fisico collaboratore di Berndsen, Cassidy, si è rivolto ad AlphaFold. Lo ha utilizzato per generare previsioni a risoluzione atomica della struttura della proteina e poi ha perfezionato le forme previste confrontandole con i dati dell’immagine crio-EM.
Affrontare il problema utilizzando sia la microscopia crio-EM che Alphafold è ciò che ha sbloccato questa svolta, afferma Cassidy: “AlphaFold ha svolto un ruolo profondo in questa scoperta, fornendo la materia prima per interpretare la nostra struttura sperimentale in un modo che prima era francamente impossibile”.
Il modello risultante ha rivelato la proteina chiave del colesterolo cattivo in notevole dettaglio: un guscio simile a una gabbia che avvolge ciascuna particella LDL, inclusa una cintura a forma di nastro che mantiene la particella intatta nel flusso sanguigno. La conoscenza di questa struttura apre nuove possibilità per prevenire, diagnosticare e trattare il colesterolo alto e l’ASCVD, comprese terapie che potrebbero colpire più precisamente le LDL. Il potenziale beneficio per la salute globale è difficile da sopravvalutare.
Anche se tali applicazioni richiederanno tempo, rivelare la struttura di apoB100 è un risultato fondamentale e profondamente soddisfacente per Berndsen. “È stata la prima struttura che ho analizzato con AlphaFold la settimana in cui è diventato disponibile, e la prima proteina che ho voluto esaminare con la nostra macchina crio-EM a due piani”, afferma. “Risolvere la struttura di apoB100 è stato un sogno diventato realtà”.
Fonte: deepmind.google


